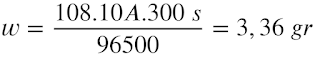7. Alumunium diperoleh dari elektrolisis lelehan Al2O3. Berapa alumunium dapat diperoleh setiap jam jika digunakan arus 100 ampere
PEMBAHASAN
Pernyataan yang benar tentang periode gelombang adalah.....A. Periode berbanding lurus dengan frekuensiB. Semakin kecil periode semakin kecilfrekuensiC. Periode berbanding terbalik dengan cepat rambat gelombangD. Periode berbanding lurus dengan banyakgelombangE. Semakin besar periode semakin kecil panjang gelombang
PEMBAHASAN
4. Hitunglah massa perak yang dapat dibebaskan oleh arus 10 ampere yang dialirkan selama 5 menit ke dalam larutan AgNO3 (Ar Ag =108)
PEMBAHASAN
Terdapat larutan berikut:Na2CO3NaCNNH4ClCH3COONaKClPasangan garam yang bersifat basa ditunjukkan nomor ….
- Na2CO3
- NaCN
- NH4Cl
- CH3COONa
- KCl
PEMBAHASAN
| Asam Kuat | Asam Lemah | Basa Kuat | Basa Lemah |
| HCl | HF | LiOH | Mg(OH)2 |
| HBr | CH3COOH | NaOH | NH4OH |
| HI | HCOOH | KOH | Cu(OH)2 |
| HNO3 | HNO2 | Ca(OH)2 | Fe(OH)2 |
| H2SO4 | H3PO4 | Sr(OH)2 | Fe(OH)3 |
| HClO3 | H2S | Ba(OH)2 | Zn(OH)2 |
| HClO4 | H2CO3 | ||
| HCN |
- Na2CO3 terdiri dari NaOH dan H2CO3 (basa kuat + asam lemah → basa).
- NaCN terdiri dari NaOH dan HCN (basa kuat + asam lemah → basa).
- NH4Cl terdiri dari NH4OH dan HCl (basa lemah + asam kuat → asam)
- CH3COONa terdiri dari CH3COOH dan NaOH (asam lemah + basa kuat → basa)
- KCl terdiri dari KOH dan HCl (basa kuat + asam kuat → netral)
2. Diketahui potensial elektroda dari :Al3+ + 3e → Al Eo = –1,66 voltFe3+ + 3e → Fe Eo = − 0,44 voltReaksi redoks:
PEMBAHASAN
Suatu larutan yang bersifat asam HB 0,1 M memiliki warna yang sama ketika ditetesi dengan indikator universal dengan larutan HCl 0,001 M. Tentukan nilai Ka dari HB
PEMBAHASAN
6. Fluorin dapat diperoleh dari elektrolisis leburan KHF2, sesuai persamaan reaksi,HF2-—> HF + 1/2 F2+ e. Jika arus listrik yang digunakan 20 A selama 29 menit, volume gas fluorin yang dihasilkan adalah (diukur pada 0°C, 1 atm) Ar F = 19.
PEMBAHASAN
5. Fluorin dapat diperoleh dari elektrolisis leburan KHF2, sesuai persamaan reaksi,HF2 HF + ½ F2+ e. Untuk menghasilkan gas fluorin sebanyak 2,24 liter (STP), muatan listrik yang diperlukan adalah (1F = 96500C)
PEMBAHASAN
2. Bila ke dalam larutan NiSO4 dialirkan listrik sebesar 0,1 F dan Ar Ni = 59, maka di katode akan diperoleh logam Ni berapa gram?
PEMBAHASAN
Dalam elektrolisis larutan CuSO4 dengan elektroda inert, dihasilkan 224 mL gas (STP) di anode, massa endapan yang didapat di katoda adalah (Ar Cu 63,5)
PEMBAHASAN
5. Fluorin dapat diperoleh dari elektrolisis leburan KHF2, sesuai dengan reaksi, HF2^- —> HF+ 1/2 F2 + e. Waktu yang diperlukan untuk memperoleh 26,88 liter F2 (pada 0°C, 1 atm) dengan arus 10 ampere adalah 19) (Ar F = 19)
PEMBAHASAN
Dalam elektrolisis, sejumlah 3,18 gram Cu (Ar Cu = 63,5) diendapkan di katoda yang tersusun atas larutan Cu²+(aq) dengan elektroda inert. Jika jumlah listrik yang digunakan sama, volume gas H2 yang dihasilkan dari elektrolisis larutan H2SO4 encer pada 27 °C, 760 mmHg adalah ...?(R = 0,08)
PEMBAHASAN
Kuasa untuk menerima atau melakukan sesuatu yang mestinya diterima/dilakukan oleh pihak-pihak yang lain yang pada prinsipnya dapat dituntut secara paksa olehnya disebut ...
5. Dalam elektrolisis larutan Cu(NO3)2 dengan elektroda inert, 1,27 gram Cu (Ar Cu 63,5) diendapkan, volume gas yang dihasilkan di anode pada 1 atm, 0 °C adalah ....?
PEMBAHASAN
10. Pada pemanasan sempurna karbonat dengan reaksi: CaCO3(s) CaO(s) + CO2(g) 75 gram kalsium, Pada keadaan standar volume gas CO2 yang terbentuk 11,2 liter. Kemurnian kalsium karbonat adalah...? (Ar Ca=40, C=12, 0=16)
PEMBAHASAN
8. kedalam larutan Ba(OH)2 dimasukkan 10 mL H2so4 terjadi reaksiBa(OH)2 + H2SO4 —> BaSO4 + 2H2OTerbentuk endapan 0,2333 gram,konsentrasi H2SO4 yang direaksikan adalah ...?(Ar Ba=137, S=32, O=16)
PEMBAHASAN
Jika diketahui :Zn+2 / Zn Eo = –0, 76 VoltCu+2 / Cu Eo = +0,34 VoltDiagram sel yang paling tepat untuk menggambarkan proses tersebut adalah...
Jika diketahui :
Zn+2 / Zn Eo = –0, 76 Volt
Cu+2 / Cu Eo = +0,34 Volt
Diagram sel yang paling tepat untuk menggambarkan proses tersebut adalah...
A. ZnSO4 / Zn // CuSO4 / Cu
B. Cu / CuSO4 // ZnSO4 / Zn
C. Zn / Zn+2 // Cu+2 / Cu
D. Cu / Cu+2 // Zn+2 / Zn
E. Zn+2 / SO42- // Cu+2 / SO42-
PEMBAHASAN
Zn²+|Zn Eº = -0,76 V
Cu²+|Cu E° = +0,34 V
Keterangan:
- Cu sebagai katoda, E° lebih tinggi.
- Zn sebagai anoda, E° lebih rendah.
- Sebelah kiri anoda Zn terjadi oksidasi logam menjadi ion.
- Sebelah kanan katoda Cu terjadi oksidasi ion logam menjadi endapannya.
A. –0,42 Volt
B. –1,10 Volt
C. +0,42 Volt
D. +1,10 Volt
E. +11,0 Volt
Jawaban D
PEMBAHASAN
Dijawab:
E°sel = E°reduksi – E°oksidasi
E°sel = E°Cu – E°Zn
E°sel = +0,34 - (-0,76)
E°sel = +1,1 V
E°sel > 0,(reaksi spontan)
Tegangan suatu sel, yang setengah sel-selnya diberikan di bawah ini :Mg2+ + 2 e → Mg (s) E = –2,37 VCu2+ + 2 e → Cu (s) E = +0,34 V ialah...A. − 2,03 volt B. +1,35 volt C. +2,71 volt D. +2,03 volt E. −1,02 volt
PEMBAHASAN
10. Ditimbang 2 gram Kristal NaOH dilarutkan sampai volum 1 Liter. Kemudian larutan ini digunakan untuk menitrasi larutan HCI 0,1 M, Pada setiap 10 mL larutan HCI rata-rata membutuhkan 25 mL larutan NaOH tersebut, hitunglah berapa % kemurnian kristal NaOH tersebut! (Na=23, O=16, H=1)
PEMBAHASAN
10. Diketahui Ksp CaCO3 = 4,0 × 10–10 dan Mr CaCO3 = 100. Kelarutan garam CaCO3 dalam tiap 200 mL larutan adalah … ?
PEMBAHASAN
Senyawa diklorodifluorometana, CC12F2 banyak dipakai sebagai aerosol propelan atau pendingan pada pengatur temperatur ruangan (AC), dan bersifat inert (sukar bereaksi). Di antara pernyataan berikut yang benar mengenai senyawa inert tersebut adalah?
PEMBAHASAN
Pehatikan persamaan termokimia berikut: 2H2(g) + 2Cl2(g) 4HCI(g); ΔH=-92,4 kJDi antara pernyataan berikut yang tidak benar mengenai persamaan termokimia di atas adalah?
PEMBAHASAN
Entalpi pembentukan standar (ΔHr°) timbel(II) karbonat adalah -699 kJ/mol. Pernyataan persamaan termokimia yang paling tepat untuk proses tersebut adalah?A. Pb(s) + C(s) + O2(g) → PbCO3(s); AHP = +699 kJ/mol B. Pb(s) + C(s) + 3/2 O2(g) PbCO3(s): AH-699 kJ/mol
PEMBAHASAN
Intensitas bunyi titik X yang berjarak 1 meter dari sumber adalah 10 Wm 2. Jika digunakan insensitas ambang 10-12 Wm-2 dan titik Y berjarak 10 meter dari sumber bunyi maka perbandingan taraf intensitas dititik X dan Y adalah...A. 1:3B. 3:2C. 3:5D. 5:1E. 5:3
PEMBAHASAN
5. Suatu sampel gas sebanyak 0,238 g dalam 100 mL wadah pada temperatur 14 °C memberikan tekanan sebesar 600 mmHg gas tersebut adalah?
PEMBAHASAN
10. Dari persamaan reaksi berikut ini: SnO2(s) + 2H2(g) → Sn(s) + 2H2O(1)Volume gas hidrogen (diukur pada 1 atm dan 273 K) yang dibutuhkan untuk bereaksi sempurna dengan 2,00 g SnO2 adalah?
PEMBAHASAN
Di laboratorium gas klor dapat dibuat dari reaksi antara HCI dengan MnO2. Persamaan reaksi setara adalah: MnO2(s) + 4 HCl(aq) → Cl2(g) + MnCl2(aq) + 2H2O(l) Bila reaksi berlangsung sempurna, massa larutan HCI pekat (36,0% berat) yang diperlukan untuk menghasilkan Cl₂ sebanyak 2,50 g adalah ?
PEMBAHASAN
Berikut ini adalah rumus struktur guanidin yang terdapat dalam urin dan hasil metabolisme protein: Persen massa nitrogen dalam guanidin adalah
PEMBAHASAN
Sebanyak 1,5 mL sampel larutan asam sulfat dari suatu baterai mobil dititrasi dengan 23,7 mL larutan NaOH 1,47 M menggunakan indikator fenolftalein untuk menentukan titik akhir titrasi. Konsentrasi (dalam satuan molaritas) sampel larutan asam sulfat tersebut adalah?
PEMBAHASAN
7. Sebanyak 1,50 g sampel suatu bijih yang mengandung perak dilarutkan. Semua Ag yang larut diubah menjadi 0,124 Ag₂S. Persen massa Ag dalam bijih tersebut adalah ?
PEMBAHASAN
7. Muscovite adalah salah satu dari mineral mika dengan rumus senyawa KAl2(SiзAIO10)(OH)2. Hasil analisis sejumlah sampel muscovite menunjukkan kandungan Si sebanyak 0,42 g. Massa sampel muscovite yang dianalisis adalah ?
PEMBAHASAN
Tentukan gram Ca(OH)2 yang diperlukan untuk menetralkan 10 mL larutan HNO3 0,05 M, jika diketahui Ar Ca = 40, O = 16, dan H = 1
PEMBAHASAN
Rumus Cara Menghitung Kekuatan Lensa Kacamata
P = - 100/PR
P = 100/sn - 100/PP
Seorang siswa dengan massa 55 kg duduk pada jok sepeda motor. Akhirnya, kedua shockbreaker motor memendek sejauh 4 cm dari kedudukan semula. Tentukan konstanta setiap shockbreaker tersebut !
PEMBAHASAN
Berapakah volume larutan NaOH 1 M yang diperlukan untuk menetralkan 50 mL larutan H2SO4 0,5 M?
PEMBAHASAN
Peristiwa penyebaran atau pembelokan gelombang ketika melalui celah sempit adalah salah satu karakteristik gelombang yang disebut dengan istilah.....A. PolarisasiB. PembiasanC. InterferensiD. PenyempurnaanE. Difraksi
PEMBAHASAN
41. Di antara kelompok senyawa berikut yang termasuk aldehida, asam, dan alkohol (tidak perlu berurutan) adalah?A. HCO2H, CH3CO2CH3, CH3CH2OHB. H2CO, CH3CH2OH, CH3CO2CH3C. CH3CO2H, CH3OH, CH3CH2OCH3
PEMBAHASAN
6. Di antara kelima senyawa organik di bawah ini yang paling benar tata namanya secara IUPAC adalahA. 2-bromo-4-hidroksi-4-petenaB. 2-metil-1-petena-4-ol
PEMBAHASAN
7. Jika NaBr larut dalam air, maka jenis gaya antarmolekul yang harus diputuskan adalah ?
PEMBAHASAN
a. Ikatan kovalen non-polar merupakan ikatan kimia antar atom dengan perbedaan kelektronegatifan kurang dari 0.5 sehingga PEI terletak di tengah.b. ikatan kovalen polar terbentuk dari atom-atom dengan perbedaan kelektronegatifan besar, sehingga PEI tertarik ke atom dengan harga kelektronegatifan besar.
7. Consider the reaction: Cr2O72 + 14H+ + 6e- —> 2Cr3+ + 7H2O what is the quantity of electricity in coulombs needed to reduced 1 mol of Cr2O72 ?
SOLUTION
Untuk mengoksidasi 25 gram cuplikan FeSO4 (Mr = 152), diperlukan 6,125 gram K2Cr2O7 (Mr = 294). Pada reaksi ini ion dikromat berubah menjadi Cr3+, sedangkan Fe2+ berubah menjadi Fe3+. Kadar FeSO4 dalam cuplikan di atas adalah ?
PEMBAHASAN
Larutan CH3COOH 0,01 M,Harga Ka = 1,8 x 10-5,nilai kosentrasi ion H+ larutan tersebut adalah……
PEMBAHASAN
Ditanya: nilai kosentrasi ion H+ ?
Dijawab:
Nilai konsentrasi ion H⁺ pada larutan CH₃COOH 0,01 M dapat ditentukan menggunakan rumus asam lemah, sebagai berikut :
[H+] = √(1,8 x 10-5×0,01)
Jadi, nilai konsentrasi ion [H+] pada larutan CH3COOH adalah 4,2 × 10⁻⁴
Di antara senyawa alkana berikut ini yang mempunyai interaksi van der Waals paling tinggi adalah ?A. CH3CH2CH2CH2CH2CH3B. CH3CH2CH3C. CH3CH2C(CH2)4CH3D. CH3CH2CH2CH3E. CH3(CH2)CH3
PEMBAHASAN
Nama senyawa alkil karbon berdasarkan jumlah atom C
C1 = Metil
C2 =Etil
C3 = Propil
C4 = Butil
C5 = Pentil
C6 = Heksil
C7 = Heptil
C8 = Oktil
C9 = Nonil
C10 = Dekil
Hanya sekedar mengulang pelajaran di sekolah, Kelompok senyawa karbon dapat dibedakan menjadi tiga bagian yaitu berdasarkan rumus kimianya :
1. Alkana
Alkana adalah senyawa karbon dengan hidrogen yang mempunyai rumus kimia CnH2n+2. Misal C2H6 dengan nama Etana, C3H8 dengan nama Propana.
2. Alkena
Alkena yakni senyawa karbon hidrogen dengan rumus kimia CnH2n. Contohnya adalah C3H6 dengan nama propena serta C4H8 dengan nama Butena.
3. Alkuna
Alkuna adalah senyawa karbon hidrogen dengan rumus kimia CnH2n-2. Contoh C5H8 dengan nama Pentuna dan C6H10 dinamai heksuna.