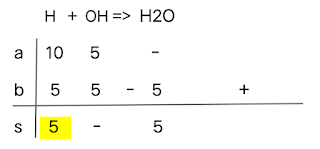
Berapakah konsentrasi ion [OH–] dalam larutan jika konsentrasi H+ = 2 X 10-4 M (Diketahui Kw= 10-14)……
Contoh soal kimia
Berapakah konsentrasi ion [OH–] dalam larutan jika konsentrasi H+ = 2 X 10-4 M (Diketahui Kw= 10-14)...
A. 5 X 10-10
B. 5 X 10-18
C. 0,2 X 10-10
D. 0,2 X 10-8
E. 2 X 10-10
PEMBAHASAN
Diketahui:
[H+] = 2x10^-4 M
Kw = 10-14
Ditanya: konsentrasi ion [OH–] ?
Dijawab:
H2O => H+(aq) + OH–(aq)
Menentukan konsentrasi ion [OH–] dapat dihitung dengan rumus tetapan kesetimbangan air (kw) berikut ini.
Kw = [H+][OH–]
10-14 = 2x10^-4 . [OH–]
[OH–] = 10-14/2x10^-4
[OH–] = 5x10-10
Jadi, konsentrasi ion [OH–] larutan diatas adalah 5x10-10
100 mL larutan asam yang mempunyai pH = 1 dicampur dengan 50 mL larutan basa yang mempunyai pH = 13 hitung pH larutan yang terjadi
100 mL larutan asam yang mempunyai pH = 1 dicampur dengan 50 mL larutan basa yang mempunyai pH = 13 hitung pH larutan yang terjadi !
PEMBAHASAN
Diketahui:
Larutan asam pH = 1
Va = 100 mL
Larutan basa pH = 13
Vb = 50 mL
Ditanya: pH larutan ?
Dijawab:
Asam
pH = 1
[H+] = 10-1
Basa
pH = 13
[OH-] = 14 – 13
[OH-] = 1 => 10-1
Menghitung hasil reaksi [H+] dan [OH-]:
n[H+] = M×V = 10-1 × 100 = 10 mmol
n[OH-] = M×V = 10-1 × 50 = 5 mmol
[H+] = a . Ma
[H+] = 1 . nsisa/ntotal
[H+] = 1 . 5/150
[H+] = 3,4×10-2
[H+] = 2 - log 3,4
Jadi, pH larutan yang terjadi adalah [H+] = 2 - log 3,4
Di antara zat berikut iniI. HCI(g)II. Na(s) III. HCl(aq)IV. F2(g)Yang mempunyai nilai entalpi pembentukan standar AH°f = 0 adalah?
Di antara zat berikut ini
I. HCI(g)
II. Na(s) III. HCl(aq)
IV. F2(g)
Yang mempunyai nilai entalpi pembentukan standar AH°f = 0 adalah
A. I, II, III, dan IV
B. I, II, dan IV
C. I dan II
D. II dan IV
E. Hanya II
Jawaban (D)
PEMBAHASAN
Jawab:
AH°f = 0 terdapat di dalam unsur monoatomik ataupun diatomik, tetapi tidak ada dalam molekul senyawa. Na dan F2 adalah unsur, jadi AHºf = 0
5. Periksalah dengan suatu perhitungan, apakah akan terjadi pengendapan jika 50 mL larutan Pb(NO3)2 0,1M dicampurkan dengan 50 mL larutan KCl 0,1 M ?
Pertanyaan !
5. Periksalah dengan suatu perhitungan, apakah akan terjadi pengendapan jika 50 mL larutan Pb(NO3)2 0,1M dicampurkan dengan 50 mL larutan KCl 0,1 M ?
PEMBAHASAN
Diketahui: Ksp PbCl2 = 1,6×10-5
Jawab : 50
50 mL Pb(NO3)² 0,1 M = x 0,1 = 5.10-3 mol
1000
50
50 mL KCl 0,1 M = x 0,1 = 5.10-3 mol
1000
Volume campuran = 50 mL + 50 mL = 100 mL
1000
[Pb2+] = 5.10-3 x = 5.10-2 mol/L
100
1000
[Cl-] = 5.10-3 x = 5.10-2 mol/L
100
PbCl2 (aq) Pb2+ (aq) + 2 Cl- (aq)
Qc = [Pb2+ ] [Cl- ]²
Qc = ( 5.10-2 )( 5.10-2 )2 = 1,25 .10-4
Karena Qc > Ksp PbCl2, maka pada pencampuran itu terbentuk endapan.
7. Tulislah ! hubungan kelarutan dengan tetapan hasil kali kelarutan untuk elektrolit berikut :a. Al(OH)3b. Ca3(PO)4
7. Tulislah hubungan kelarutan dengan tetapan hasil kali kelarutan untuk elektrolit berikut :
a. Al(OH)3
b. Ca3(PO)4
PEMBAHASAN
Jawab :
a. Al(OH)3 (s) Al3+(aq) + 3 OH- (aq)
s s 3s
Jika kelarutan Al(OH)³ = s mol/L, maka konsentrasi ion Al3+ = s mol/L dan konsentrasi ion OH- = 3s mol/L.
Ksp = [Al3+ ] [OH- ]3
Ksp = (s) (3s)3
Ksp = 27 s4
b. Ca3(PO)4 3 Ca2+ (aq) + 2 PO43- (aq)
s 3 s 2 s
Ksp Ca3(PO)4 = [Ca2+ ]3 [PO43- ]²
Ksp Ca3(PO)4 = (3s)³ (2s)²
Ksp Ca3(PO)4 = 108 s5
Berapakah kelarutan CaC2O4 dalam air?b) Berapa kelarutan CaC2O4 dalam satu liter larutan yang mengandung CaCl2 0,15 mol?
a). Berapakah kelarutan CaC2O4 dalam air?
b). Berapa kelarutan CaC2O4 dalam satu liter larutan yang mengandung CaCl2 0,15 mol?
PEMBAHASAN
Jawab :
a. Misal kelarutan CaC2O4 dalam air = s mol/L
CaC2O4(s) Ca2+ (aq) + C2O42-
s mol/L s mol/L s mol/L
Ksp CaC2O4 = [Ca2+] [C2O42- ]
2,3.10-9 = (s). (s) = s2
s = 2,3 . 10-9
s = 4,8 .10-5
Kelarutan CaC2O4 dalam air = 4,8 .10-5 mol /L
b. Misal kelarutan CaC2O4 dalam CaCl2 = s mol / L
CaC2O4 Ca2+ (aq) + C2O42-
s mol/L (s + 0,15) mol/L s mol/L
Ca2+ dari CaCl2 = 0,15 mol.
Nilai tersebut bahkan jauh lebih besar dari nilai Ca2+ dari CaC2O4 sehingga (s + 0,15) ~ 0,15 mol
Ksp CaC2O4 = [Ca2+] [C2O42- ]
2,3.10-9 = (0,15) ( s)
s = 1,5 . 10-8
Jadi, kelarutan CaC2O4 dalam larutan CaCl2 0,15 adalah M = 1,5 . 10-8 mol / L
6. Berapakah konsentrasi minimum ion CO32- yang diperlukan untuk mengendapkan ion Ca2+ dari larutan Ca(NO3)2 0,01 M ? Ksp CaCO3 = 4,8 x 10-9 ?
6. Berapakah konsentrasi minimum ion CO32- yang diperlukan untuk mengendapkan ion Ca2+ dari larutan Ca(NO3)2 0,01 M ? Ksp CaCO3 = 4,8 x 10-9 ?
PEMBAHASAN
Jawab :
CaCO3 akan mengendap apabila [Ca2+ ] [CO32-] > Ksp CaCO3
[Ca2+ ] = [Ca(NO3)2 ] = 0,01 M
(0,01).[ CO32-] > 4,8 x 10-9
[CO32-] > 4,8 x 10-7
Jadi, CaCO3 akan mengendap jika [CO32-] > 4,8 x 10-7
Tulislah persamaan tetapan hasil kali kelarutan untuk garam/basa berikut :a. AgCl b. Ca3(PO)4 d. Al(OH)3
Tulislah ! persamaan tetapan hasil kali kelarutan untuk garam/basa berikut :
a. AgCl
b. Ca3(PO)4
d. Al(OH)3
PEMBAHASAN
Jawab :
a. AgCl(s) Ag+ (aq) + Cl- (aq)
Ksp = [Ag+] [Cl-]
b. Ca3(PO)4 3 Ca2+ (aq) + 2 PO43- (aq)
Ksp = [Ca2+ ]3 [PO43- ]2
c. Al(OH)3(s) Al3+ (aq) + 3 OH- (aq)
Ksp = [Al3+ ] [OH- ]3
Catatan:Senyawa yang mempunyai Ksp adalah senyawa elektrolit yang sulit untuk larut. Sedangkan senyawa elektrolit yang mudah larut contohnya NaCl, Na2SO4, KOH, HCl, atau H2SO4 karena tidak memiliki Ksp. Selain itu, senyawa yang sukar larut tetapi nonelektrolit seperti benzena, minyak atau eter juga tidak mempunyai Ksp.
9. Panas sebesar 12 kj diberikan pada pada sepotong logam bermassa 2500 gram yang memiliki suhu 30°C. Jika kalor jenis logam adalah 0,2 kalori/gr°C, tentukan suhu akhir logam!
9. Panas sebesar 12 kj diberikan pada pada sepotong logam bermassa 2500 gram yang memiliki suhu 30°C. Jika kalor jenis logam adalah 0,2 kalori/gr°C, tentukan suhu akhir logam!
PEMBAHASAN
Diketahui:
Q = 12 kilojoule = 12000 joule
m = 2500 gram = 2,5 kg
T1 = 30oC
Ditanya: berapa suhu akhir logam (T2 ) ?
Jawab:
c = 0,2 kal/groC = 0,2 x 4200 joule/kg oC
c = 840 joule/kg oC
Q = mcΔT
12000 = (2,5)(840)ΔT
ΔT = 12000/2100 = 5,71 oC
T2 = T1 + ΔT
T2 = 30 + 5,71
T2 = 35,71 oC
Jadi, suhu akhir logam yang diketahui adalah 35,71°C
1. 500 gram es bersuhu −12oC dipanaskan hingga suhu −2oC. Jika kalor jenis es adalah 0,5 kal/goC, tentukan banyak kalor yang dibutuhkan, nyatakan dalam satuan joule!
1. 500 gram es bersuhu −12oC dipanaskan hingga suhu −2oC. Jika kalor jenis es adalah 0,5 kal/goC, tentukan banyak kalor yang dibutuhkan, nyatakan dalam satuan joule!
PEMBAHASAN
Diketahui:
m = 500 gram
T1 = −12oC
T2 = −2oC
ΔT = T2 − T1
ΔT = −2o − (−12 )
ΔT = 10oC
c = 0,5 kalori/groC
Ditanya: banyak kalor yang dibutuhkan, nyatakan dalam satuan joule (Q) ?
Jawab:
Q = mcΔT
Q = (500)(0,5)(10)
Q = 2500 kalori
[1 kalori = 4,2 joule]
Q = 2500 x 4,2
Q = 10500 joule
5. Jika diketahui:Fe 2+ + 2 e - → Fe Eo = -0.44 voltAg+ + e - → Ag Eo = +0.8 voltMaka potensial sel untuk reaksi:Fe (s) + 2AgNO3(aq) → Fe(NO3)2(aq) + 2Ag(s) adalah...
5. Jika diketahui:
Fe 2+ + 2 e - → Fe Eo = -0.44 volt
Ag+ + e - → Ag Eo = +0.8 volt
Maka potensial sel untuk reaksi:
Fe (s) + 2AgNO3(aq) → Fe(NO3)2(aq) + 2Ag(s) adalah...
PEMBAHASAN
Fe2+ + 2e → Fe E° = -0.44 V
Ag+ + e → Ag E° = -0.80 V
Ditanya: hitung potensial sel untuk reaksi:
Fe (s) + 2AgNO3(aq) → Fe(NO3)2(aq) + 2Ag(s) !
Fe mengalami oksidasi, ditandai dengan kenaikan biloks dari 0 menjadi +2
Ion Ag mengalami reduksi, ditandai dengan penurunan biloks 1 menjadi 0
E° sel = E° reduksi - E° oksidasi
E° sel = E° Ag - E° Fe
E° sel = 0,80 - (-0,44)
E° sel = 1,24 Volt
Jadi, potensial sel untuk reaksi:
Fe (s) + 2AgNO3(aq) → Fe(NO3)2(aq) + 2Ag(s) adalah 1,24 V
Pada elektrolisis larutan CuSO4 dihasilkan 25,4 gram endapan Cu pada katode. Hitunglah volume gas H2 (0 °C, 1 atm) yang dibebaskan pada elektrolisis larutan H2SO4 encer dengan jumlah arus yang sama (Ar Cu= 63,5; 0 = 16)
Pada elektrolisis larutan CuSO4 dihasilkan 25,4 gram endapan Cu pada katode. Hitunglah volume gas H2 (0 °C, 1 atm) yang dibebaskan pada elektrolisis larutan H2SO4 encer dengan jumlah arus yang sama (Ar Cu = 63,5; 0 = 16)
PEMBAHASAN
Cu⁺² + 2 e⁻ —> Cu
H₂SO₄ —> 2 H⁺ + SO₄⁻²
maka reaksi di katode, sebagai berikut:
2 H⁺ + 2 e⁻ —> H₂
Langkah berikutnya yaitu menentukan massa H₂ yang bisa kita hitung sebagai berikut:
G Cu : G H₂ = ME Cu : ME H₂
25,4 gram : G H₂ = 63,5/2 : 2/2
25,4 gram : G H₂ = 31,75 : 1
G H₂ = 25,4 gram / 31,75
G H₂ = 0,8 gram
Sebelum menghitung volume pada keadaan 0°C dan tekanan 1 atm (STP), tahap selanjutnya yaitu menentukan jumlah mol terlebih dahulu dengan rumus, berikut ini:
mol = massa / Mr
mol = 0,8 gram / 2
mol = 0,4 mol
terakhir, menghitung volume pada kedaaan STP, yaitu:
Volume (STP) = mol x 22,4 L
Volume = 0,4 x 22,4 L
Volume = 8,96 Liter
Jadi, volume gas H₂ yang dibebaskan adalah 8,96 Liter.
9. Jika diketahui:Zn2+ + 2 e- → Zn Eo = -0.74 voltCu 2+ + 2 e- → Cu Eo = +0,34 voltMaka potensial sel (Eo) untuk reaksi:Cu2+ + Zn → Cu + Zn2+ adalah.
9. Jika diketahui:
Zn2+ + 2 e- → Zn Eo = -0.74 volt
Cu 2+ + 2 e- → Cu Eo = +0,34 volt
Maka potensial sel (Eo) untuk reaksi:
Cu2+ + Zn → Cu + Zn2+ adalah...
PEMBAHASAN
Menentukan potensial sel pada reaksi:
Cu2+ + Zn —> Cu + Zn2+
- Zn oksidasi, karena biloks naik dari O menjadi +2;
- ion Cu reduksi, disebabkan biloks turun dari +2 menjadi 0.
E° sel = E° reduksi - E° oksidasi
E° sel = E° Cu - E° Zn
E° sel = 0, 34 - (0, 74)
E° sel = 1, 8 V
Maka potensial sel (Eo) untuk reaksi:
Cu2+ + Zn → Cu + Zn2+ adalah 1,8 V
Berapakah konsentrasi 5 mL HCl yang dapat dinetralkan oleh 20 mL larutan Ba(OH)2 0,001 M?
Berapakah konsentrasi 5 mL HCl yang dapat dinetralkan oleh 20 mL larutan Ba(OH)2 0,001 M?
PEMBAHASAN
Diketahui:
VHCl = 5 mL
Ba(OH)2 = 0,001 M
VBa(OH)2 = 20 mL
Ditanya: konsentrasi asam HCl (M) ?
Dijawab:
HCl→ H⁺ (aq) + Cl⁻ (aq)
Ba(OH)₂ (aq) → Ba²⁺ (aq) + 2OH⁻ (aq)
Mol H⁺ = mol OH⁻
a . Masam (HCl) . VHCl = b . Mbasa . VBa(OH)2
1 . Masam (HCl) . 5 = 2 . 0,001 . 20
Masam (HCl) = 0,04/5
Masam (HCl) = 0,008 M
Jadi, konsentrasi asam HCl yang dapat dinetralkan adalah 0,008
25. Dalam elektrolisis larutan LSO4 dengan elektrode inert, dihasilkan 448 mL gas di anode (STP), dan 2,56 gram endapan logam L di katoda Ar L adalah
25. Dalam elektrolisis larutan LSO4 dengan elektrode inert, dihasilkan 448 mL gas di anode (STP), dan 2,56 gram endapan logam L di katoda Ar L adalah .....
Katode : 2L2+ + 4e ⟶ 2L
Anode : 2H2O ⟶ 4H+ + O2 + 4e
2L2+ + 2H2O ⟶ 2L + 4H+ + O2
Karena gas O2 yang dihasilkan diukur pada keadaan STP maka:
jumlah mol gas O2 = 0,448 L : 22,4 L/mol
PEMBAHASAN
Elektrolisis larutan LSO4 :
Katode : 2L2+ + 4e ⟶ 2L
Anode : 2H2O ⟶ 4H+ + O2 + 4e
2L2+ + 2H2O ⟶ 2L + 4H+ + O2
Karena gas O2 yang dihasilkan diukur pada keadaan STP maka:
jumlah mol gas O2 = 0,448 L : 22,4 L/mol
mol gas O2 = 0,02 mol
Jadi, endapan logam L di katoda Ar L adalah 0,02 mol
2. Sejumlah arus dapat mengendapkan 1,08 gram perak dari larutan perak nitrat (AgNO3). Jika arus yang sama dialirkan ke dalam nikel sulfat (NISO4), berapa gram nikel dapat diendapkan? (Ar Ni = 59; Ag = 108)
2. Sejumlah arus dapat mengendapkan 1,08 gram perak dari larutan perak nitrat (AgNO3). Jika arus yang sama dialirkan ke dalam nikel sulfat (NISO4), berapa gram nikel dapat diendapkan? (Ar Ni = 59; Ag = 108)
PEMBAHASAN
Reaksi elektrolisis yg terjadi:
Ag+ + e- —> Ag
Ni2+ + 2 e- —> Ni
Ditanya: berapa gram nikel dapat diendapkan (m)?
Jawab:
m = e.F
Diketahui bahwa Jumlah muatan yg mengalir bernilai sama sehingga nilai F juga sama.
Diketahui bahwa Jumlah muatan yg mengalir bernilai sama sehingga nilai F juga sama.
m Ag ÷ m Ni = e Ag ÷ e Ni
1,08 ÷ m Ni = 108/1 ÷ 59/2
1,08 m Ni = 0,273
m Ni = 0,273 x 1,08
Massa Ni = 0.295 gram
Jadi, berat nikel yang dapat diendapkan sebanyak 0,295 gram
m Ni = 0,273 x 1,08
Massa Ni = 0.295 gram
Jadi, berat nikel yang dapat diendapkan sebanyak 0,295 gram
Pernyataan terkait kedua larutan tersebut, antara lain:1. Kedua larutan sama-sama memiliki pH = 32. Kedua larutan adalah asam lemah 3. Kedua larutan memiliki harga [H+] yang sama4. Kedua larutan dapat mengubah lakmus merah5. Kedua larutan dapat terionisasi sempurnaPasangan penjelasan yang tepat untuk kedua larutan tersebut adalah.......
Pernyataan terkait kedua larutan tersebut, antara lain:
1. Kedua larutan sama-sama memiliki pH = 3
2. Kedua larutan adalah asam lemah
3. Kedua larutan memiliki harga [H+] yang sama
4. Kedua larutan dapat mengubah lakmus merah
5. Kedua larutan dapat terionisasi sempurna
Pasangan penjelasan yang tepat untuk kedua larutan tersebut adalah.......
A. (1) dan (3)
B. (1) dan (5)
C. (2) dan (4)
D. (2) dan (5)
E. (3) dan (5)
Jawaban (A)
PEMBAHASAN
Pernyataan pertama berkaitan dengan PH.
[H+] HCI M asam 10^-3 M
PH = -log [H+]
PH = log 10^-3
PH = 3
(pernyataan pertama benar brodi)
HCI = asam kuat dan CH3COOH = asam lemah (pernyataan kedua salah brodi)
[H+] CH3COOH = √ Ka x M...
[H+] CH3COOH = √ 10^-5. 10^-1
[H+] CH3COOH = 10^-3 M
PH = -log [H+]
PH = log 10^-3
PH = 3
pernyataan ketiga benar brodi)
Jadi, jawaban dari persoalan diatas adalah A (pernyataan 1 dan 3 benar)
Langganan:
Komentar
(
Atom
)




![Pernyataan terkait kedua larutan tersebut, antara lain:1. Kedua larutan sama-sama memiliki pH = 32. Kedua larutan adalah asam lemah 3. Kedua larutan memiliki harga [H+] yang sama4. Kedua larutan dapat mengubah lakmus merah5. Kedua larutan dapat terionisasi sempurnaPasangan penjelasan yang tepat untuk kedua larutan tersebut adalah....... Pernyataan terkait kedua larutan tersebut, antara lain:1. Kedua larutan sama-sama memiliki pH = 32. Kedua larutan adalah asam lemah 3. Kedua larutan memiliki harga [H+] yang sama4. Kedua larutan dapat mengubah lakmus merah5. Kedua larutan dapat terionisasi sempurnaPasangan penjelasan yang tepat untuk kedua larutan tersebut adalah.......](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEh9fkd8D2ra_GSd0EauxSeFq__eLHz3zV5C-tFQ64M2J4XpTKNP9c2Zg6uhrtq30Motykxe5qj3jiTFmI9ta8qIUPncr4XIm9XBansQ92c1h0ksU7YAqc4kYrnB4sAXpULBwWAp_FqeSE0/w320-h99/1675215703501691-0.png)
